REACCIONES QUÍMICAS
REACCIONES QUÍMICAS
INTRODUCCIÓN
En este trabajo se mostrarán como estudiar las transformaciones químicas o más conocidas como reacciones químicas, se verá el debido proceso para este tema, cómo y los movimientos correctos para evitar errores. Las reacciones son procesos los cuales unas sustancias al mezclarse con otras reaccionan y dan origen a una o unas nuevas sustancias con propiedades diferente.
Se observará como crearlas y ajustarlas, en la cantidad exacta y los químicos correctos, clasificar las sustancias de acuerdo a sus contenidos. Se estudiará la energía, como se comporta una sustancia al juntarse con otra y que puede crear.
OBJETIVOS
*Entender cómo es que se crean estas reacciones química.
*Aprender a clasificar las reacciones químicas.
*Saber realizar cálculos con las ecuaciones químicas para llegar a estas.
*Conocer la reacciones químicas más importantes y como están compuestas.
*Saber usar las cantidades exactas de las sustancias.
PROCEDIMIENTOS
1) Reacciones químicas (que son).
2) Para qué sirven las reacciones químicas.
3)Ecuación química.
4)Como escribir una reacción química.
5)Clases de reacciones químicas.
REACCIONES QUÍMICAS
Que son? :
Las reacciones química son aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión, aunque, si bien es una realidad esto que se sostiene que los productos varían de acuerdo a las condiciones, determinadas cantidades no sufren ningún tipo de modificación y por tanto permanecen constantes en cualquier reacción química.
Las reacciones química son aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión, aunque, si bien es una realidad esto que se sostiene que los productos varían de acuerdo a las condiciones, determinadas cantidades no sufren ningún tipo de modificación y por tanto permanecen constantes en cualquier reacción química.
Para que se produzca la reacción es necesario que las moléculas de los reactantes choquen entre sí, ya que es la única manera de que puedan intercambiar átomos para dar los productos. Ésta es una condición necesaria pero no suficiente ya que el choque debe darse con una mínima energía para que los enlaces de los reactivos se puedan romper, y con la orientación que les permita unirse para formar las moléculas de los reactivos. Si se dan todas las condiciones hablaremos de choque efectivo.
Reactantes.......→.....Productos AB (g) + CD(g) → AC(g) + BD(g)
Para qué sirven las reacciones químicas:
Siempre se ha estudiado las soluciones de las reacciones químicas y su clasificación, pero no se ha profundizado en la importancia en la vida cotidiana y lo que pueden llegar a hacer.
En la vida existen muchas reacciones químicas que son muy importantes para nosotros porque desde mi punto de vista, muchas de ellas, si no hubieran ocurrido hubiera sido muy difícil haber evolucionado o sobrevivido como persona, las cuales son:
- A partir de la combustión obtenemos energía que nos ayuda para calentarnos e incluso para la preparación de nuestros propios alimentos.
- La disolución de el azúcar en el café caliente.
- Cuando quemas leña se observa como se crea una nueva sustancias, las cenizas. En el siguiente vídeo se pueden conocer otros ejemplos de reacciones químicas en la vida
Una ecuación
química es una forma
resumida de expresar, mediante símbolos y fórmulas, una reacción química. En
ella determinamos las sustancias reaccionantes, se predicen los productos y se
indican las proporciones de las sustancias que participan en la reacción.
Como identificar cuándo se ha producido una reacción química:
*Se produce una efervescencia (producción de gases).
*Se libera o absorbe energía (cambia la temperatura del matraz o recipiente donde ocurre la reacción).
*Cambio de color de los reactivos participantes.
*Aparece un precipitado o sustancia insoluble.
En la siguiete tabla aparecen los símbolos más utilizados en las ecuaciones químicas. Observa que las sustancias que actúan como reactivos se escriben del lado izquierdo de la reacción mientras que los productos en la parte derecha.
Símbolos de uso común en las ecuaciones químicas (Hein, 1992).
CÓMO ESCRIBIR UNA ECUACIÓN QUÍMICA
Para poder construir o escribir una ecuación química se debe tener en cuenta:
*Saber cómo reaccionan las sustancias y qué nuevos productos se forman.
*Toda ecuación química debe estar balanceada, es decir que debe de existir la misma cantidad de átomos de un mismo elemento de ambos lados de la ecuación química, como por ejemplo, esta es una representación de una molécula de agua oxigenada o peróxido de hidrógeno (H2O2).
Cada sustancia puede representarse por una fórmula química, cada reacción química puede representarse por una ecuación química. En ella se indican las sustancias que reaccionan o reactivos y las sustancias que se producen o productos y las cantidades relativas de las mismas para la reacción en cuestión.
1) Reacciones de síntesis o combinación: Las reacciones de síntesis o combinación ocurren cuando dos o más reactivos forman un solo producto; generalmente se libera calor (Δ) (reacción exotérmica). También se les conoce como reacciones de adición.
Como identificar cuándo se ha producido una reacción química:
*Se produce una efervescencia (producción de gases).
*Se libera o absorbe energía (cambia la temperatura del matraz o recipiente donde ocurre la reacción).
*Cambio de color de los reactivos participantes.
*Aparece un precipitado o sustancia insoluble.
En la siguiete tabla aparecen los símbolos más utilizados en las ecuaciones químicas. Observa que las sustancias que actúan como reactivos se escriben del lado izquierdo de la reacción mientras que los productos en la parte derecha.
Símbolos de uso común en las ecuaciones químicas (Hein, 1992).
Para poder construir o escribir una ecuación química se debe tener en cuenta:
*Saber cómo reaccionan las sustancias y qué nuevos productos se forman.
*Toda ecuación química debe estar balanceada, es decir que debe de existir la misma cantidad de átomos de un mismo elemento de ambos lados de la ecuación química, como por ejemplo, esta es una representación de una molécula de agua oxigenada o peróxido de hidrógeno (H2O2).
El agua oxigenada es un líquido transparente muy reactivo, por lo que se utiliza como desinfectante y bactericida. Por este motivo se requiere almacenarlo en recipientes color ámbar, que no permitan la entrada de luz y de esta manera el agua oxigenada almacenada no reaccione ni se descomponga.
El agua oxigenada por acción de la luz reacciona descomponiéndose en agua y oxígeno. Esta reacción química se escribe o produce de esta manera:
Peróxido de hidrógeno (H2O2)
CLASES DE REACCIONES QUÍMICAS
Cada sustancia puede representarse por una fórmula química, cada reacción química puede representarse por una ecuación química. En ella se indican las sustancias que reaccionan o reactivos y las sustancias que se producen o productos y las cantidades relativas de las mismas para la reacción en cuestión.
1) Reacciones de síntesis o combinación: Las reacciones de síntesis o combinación ocurren cuando dos o más reactivos forman un solo producto; generalmente se libera calor (Δ) (reacción exotérmica). También se les conoce como reacciones de adición.
*Óxido no metálico + agua produce un oxiácido: SO2(g) + H2O(l)  H2SO3(ac) [ácido sulfúrico]
H2SO3(ac) [ácido sulfúrico]
Los objetivos de estas reacciones son los siguientes:
-Producir nuevas sustancias químicas útiles al hombre que no existen en forma natural.
-Desarrollar métodos más económicos, simples y eficientes para sintetizar sustancias naturales ya existentes como el látex, el ácido ascórbico o vitamina c o el ácido acetilsalicílic, por citar algunos.
2) Reacciones de descomposición: La descomposición química es un proceso que experimentan algunos compuestos químicos en el que, de modo espontáneo o provocado por algún agente externo, a partir de una sustancia compuesta se originan dos o más sustancias de estructura química más simple. Es el proceso opuesto a la síntesis química.La descomposición química es, con frecuencia, una reacción química no deseada, pues la estabilidad de un compuesto es siempre limitada cuando se le expone a condiciones ambientales extremas como el calor, la electricidad, las radiaciones, la humedad o ciertos compuestos químicos (ácidos, oxidantes, etc.).
Los casos más frecuentes de descomposición son la descomposición térmica o termólisis, la electrólisis y la hidrólisis. La descomposición química total de un compuesto origina los elementos que lo constituyen.Una definición más amplia del término descomposición también incluye la separación de una fase en dos o más fases.
En una reacción de descomposición, una sola sustancia se descompone o se rompe, produciendo dos o mas sustancias distintas. A este tipo de reacciones se le puede considerar como el inverso de las reacciones de combinación. El material inicial debe ser un compuesto y los productos pueden ser elementos o compuestos.
*Hidratos: Cuando se calientan los hidratos se descomponen para dar lugar a agua y sal anhidra.. Un hidrato es una sal que contiene una o mas moléculas de agua por cada unidad formula y posee estructura de cristal. Cuando estas sustancias se calienta, se desprende agua.
*Cloratos: Cuando se calientan los cloratos, se descomponen dando cloruros mas oxigeno.
*Óxidos de metales: Algunos pocos se descomponen al calentarlos dando lugar al metal libre y oxigeno.
*Carbonatos: La mayoría de carbonatos se descomponen al calentarlos dando óxidos y CO2. Por ejemplo carbonato cálcico (piedra caliza) cuando se calienta forma oxido de calcio (cal viva) y CO2.
*Bicarbonatos: Los bicarbonatos en su mayoría cuando se calientan se descomponen para formar un acido mas agua y CO2.
*Agua: El agua puede descomponerse en hidrógeno y gas oxigeno por medio de una corriente eléctrica directa.
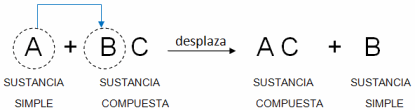
3) Reacciones de desplazamiento: Es una reacción en la que un elemento se sustituye por otro dentro un compuesto. Los materiales iniciales siempre son elementos puros, como metal de zinc puro o gas hidrógeno, más un compuesto acuoso. Cuando ocurre una reacción de sustitución, se generan como productos un nuevo compuesto acuoso puro y un elemento puro diferente. La forma general de una reacción de sustitución simple se muestra a continuación.
¡Elementos puros!
 H2SO3(ac) [ácido sulfúrico]
H2SO3(ac) [ácido sulfúrico]Los objetivos de estas reacciones son los siguientes:
-Producir nuevas sustancias químicas útiles al hombre que no existen en forma natural.
-Desarrollar métodos más económicos, simples y eficientes para sintetizar sustancias naturales ya existentes como el látex, el ácido ascórbico o vitamina c o el ácido acetilsalicílic, por citar algunos.
2) Reacciones de descomposición: La descomposición química es un proceso que experimentan algunos compuestos químicos en el que, de modo espontáneo o provocado por algún agente externo, a partir de una sustancia compuesta se originan dos o más sustancias de estructura química más simple. Es el proceso opuesto a la síntesis química.La descomposición química es, con frecuencia, una reacción química no deseada, pues la estabilidad de un compuesto es siempre limitada cuando se le expone a condiciones ambientales extremas como el calor, la electricidad, las radiaciones, la humedad o ciertos compuestos químicos (ácidos, oxidantes, etc.).
Los casos más frecuentes de descomposición son la descomposición térmica o termólisis, la electrólisis y la hidrólisis. La descomposición química total de un compuesto origina los elementos que lo constituyen.Una definición más amplia del término descomposición también incluye la separación de una fase en dos o más fases.
En una reacción de descomposición, una sola sustancia se descompone o se rompe, produciendo dos o mas sustancias distintas. A este tipo de reacciones se le puede considerar como el inverso de las reacciones de combinación. El material inicial debe ser un compuesto y los productos pueden ser elementos o compuestos.
*Hidratos: Cuando se calientan los hidratos se descomponen para dar lugar a agua y sal anhidra.. Un hidrato es una sal que contiene una o mas moléculas de agua por cada unidad formula y posee estructura de cristal. Cuando estas sustancias se calienta, se desprende agua.
*Cloratos: Cuando se calientan los cloratos, se descomponen dando cloruros mas oxigeno.
*Óxidos de metales: Algunos pocos se descomponen al calentarlos dando lugar al metal libre y oxigeno.
*Carbonatos: La mayoría de carbonatos se descomponen al calentarlos dando óxidos y CO2. Por ejemplo carbonato cálcico (piedra caliza) cuando se calienta forma oxido de calcio (cal viva) y CO2.
*Bicarbonatos: Los bicarbonatos en su mayoría cuando se calientan se descomponen para formar un acido mas agua y CO2.
*Agua: El agua puede descomponerse en hidrógeno y gas oxigeno por medio de una corriente eléctrica directa.
3) Reacciones de desplazamiento: Es una reacción en la que un elemento se sustituye por otro dentro un compuesto. Los materiales iniciales siempre son elementos puros, como metal de zinc puro o gas hidrógeno, más un compuesto acuoso. Cuando ocurre una reacción de sustitución, se generan como productos un nuevo compuesto acuoso puro y un elemento puro diferente. La forma general de una reacción de sustitución simple se muestra a continuación.
AB(ac)+C→A+CB(ac)
start color redD, A, end color redD, B, left parenthesis, a, c, right parenthesis, plus, start color greenD, C, end color greenD, right arrow, start color red, A, end color red, plus, start color greenD, C, end color greenD, B, left parenthesis, a, c, right parenthesis
¡Elementos puros!
Podemos ver que start color greenD, C, end color greenD sustituye a start color redD, A, end color redD dentro del compuesto start color redD, A, end color redD, B para formar un nuevo compuesto start color greenD, C, end color greenD, B y start color redD, A, end color redD elemental. Otra cosa que podrías notar es que start color redD, A, end color redDcomienza como un ion en solución, pero aparece en su forma elemental de lado de los productos. El reactivo start color greenD, C, end color greenD hace lo opuesto: inicia en su forma elemental de lado de los reactivos, pero termina como un ion en estado acuoso como parte del compuesto
Los elementos que forman aniones pueden sustituir el anión en el compuesto y los elementos que forman cationes pueden sustituir el catión del compuesto. Se pueden utilizar las siguientes pautas para determinar el tipo de ion que un elemento dado podría formar.
- Los metales por lo general, forman catones. Esto incluye los grupos 1 y 2, algunos elementos de los grupos 13 y 14, y los metales de transición.
- Los no metales comunes que participan en reacciones de sustitución simple son los que pertenecen al grupo 17, los cuales generalmente forman aniones con carga -1.
Las reacciones redox tienen algunos términos asociados con los que deberías familiarizarte. Revisaremos estos términos usando la siguiente reacción de ejemplo:
2Fe2O3(s)+3C(s)→4Fe(s)+3CO2(g)
Si buscamos los números de oxidación para cada átomo en los reactivos y en los productos, obtenemos lo siguiente:
+3,−2 0 0 +4,−2
Podemos usar los números de oxidación para responder la segunda parte de la pregunta 1 puesto que podemos mostrar que los números de oxidación del carbono y del hierro están cambiando durante la reacción debido a una transferencia de electrones.
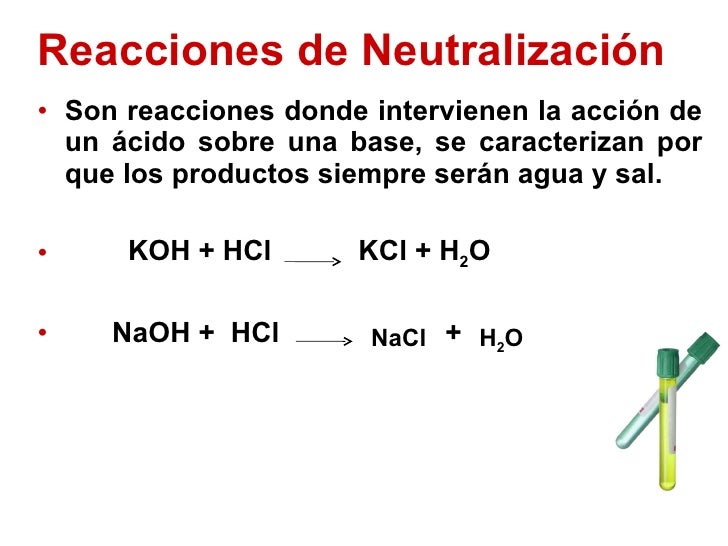
5) Reacciones de neutralización o ácido-base: Son las reacciones entre un ácido y una base, con el fin de determinar la concentración de las distintas sustancias en la disolución.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Tienen lugar cuando un ácido reacciona totalmente con una base, produciendo sal y agua. Sólo hay un único caso donde no se forma agua en la reacción, se trata de la combinación de óxido de un no metal, con un óxido de un metal.
Ácido + base → sal + agua
EJ: HCl + NaOH → NaCl + H2O
Las soluciones acuosas son buenas conductoras de la energía eléctrica, debido a los electrolitos, que son los iones positivos y negativos de los compuestos que se encuentran presentes en la solución.Una buena manera de medir la conductancia es estudiar el movimiento de los iones en una solución.
Cuando un compuesto iónico se disocia enteramente, se le conoce como electrolito fuerte. Son electrolitos fuertes por ejemplo el NaCl, HCl, H2O (potable), etc, en cambio, un electrolito débil es aquel que se disocia muy poco, no produciendo la cantidad suficiente de concentración de iones, por lo que no puede ser conductor de la corriente eléctrica.
CONCLUSIONES
*Se logró ampliar conocimientos acerca de la reacciones químicas.
*Entender su clasificación y como funciona cada una.
*Saber la composición de cada tipo de reacción para el correcto uso.
*Se aprendió para qué sirven las reacciones químicas y su importancia en la vida cotidiana.
WEBGRAFÍA









POCO MARCO TEORICO PARA BALANCEO 4.5
ResponderBorrar